Interaktion von Makrophagen und Endothelzellen bei der Blutgefäßbildung
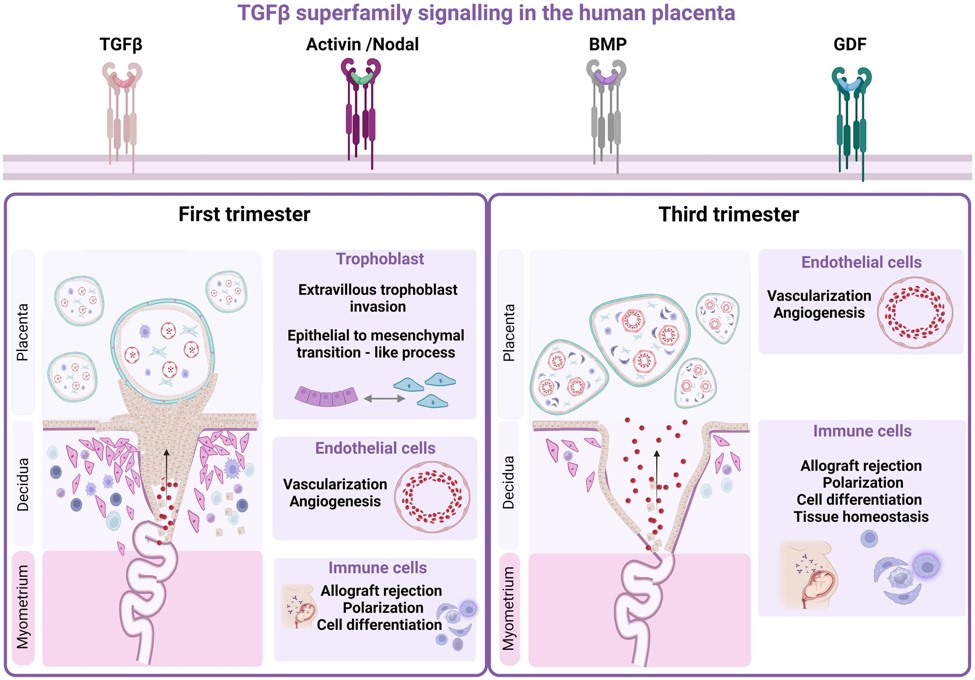
Makrophagen sind hochplastische Zellen. In der Plazenta sind sie die wichtigsten Immunzellen, erfüllen aber darüber hinaus noch viele weitere Funktionen. So fördern sie z.B. die fetale Toleranz in der Mutter, sie regulieren die Gewebehomöostase und den Gewebeumbau. Es ist bekannt, dass sie mit den Trophoblastenzellen interagieren, um die extrazelluläre Matrix zu modulieren und dadurch eine ordnungsgemäße Invasion der Trophoblasten zu ermöglichen. In der Vergangenheit wurde auch vermutet, dass sie mit Endothelzellen interagieren und die ECM umgestalten, um die angiogene Sprossung und das Wachstum neuer Blutgefäße zu ermöglichen. Hier untersuchen wir, wie Makrophagen die Angiogenese von Endothelzellen beeinflussen könnten, indem wir sowohl primäre Hofbauer-Zellen als auch aus der Plazenta isolierte feto-plazentare Endothelzellen verwenden.
Da die Monokultur eines einzelnen Zelltyps in vitro ein recht künstlicher Aufbau ist, ist es unser Ziel, ein Ko-Kulturmodell von Endothelzellen und Makrophagen zu etablieren und es in funktionellen Assays zur Angiogenese zu verwenden, um der Situation in vivo näher zu kommen. Da sich die Angiogenese und die Endothelfunktion in der Plazenta von Schwangerschaften, die durch Präeklampsie oder Diabetes beeinträchtigt sind, von denen gesunder Schwangerschaften unterscheiden, ist die Untersuchung der Endothel- und Makrophagenfunktion bei solchen Pathologien ebenfalls von wesentlicher Bedeutung.
Schliefsteiner C, Peinhaupt M, Kopp S, Lögl J, Lang-Olip I, Hiden U, Heinemann A, Desoye G, Wadsack C. Human Placental Hofbauer Cells Maintain an Anti-inflammatory M2 Phenotype despite the Presence of Gestational Diabetes Mellitus. Front Immunol. 2017 Jul 31;8:888. doi: 10.3389/fimmu.2017.00888. PMID: 28824621; PMCID: PMC5534476.
Schliefsteiner C, Ibesich S, Wadsack C. Placental Hofbauer Cell Polarization Resists Inflammatory Cues In Vitro. Int J Mol Sci. 2020 Jan 22;21(3):736. doi: 10.3390/ijms21030736. PMID: 31979196; PMCID: PMC7038058.
Loegl J, Hiden U, Nussbaumer E, Schliefsteiner C, Cvitic S, Lang I, Wadsack C, Huppertz B, Desoye G. Hofbauer cells of M2a, M2b and M2c polarization may regulate feto-placental angiogenesis. Reproduction. 2016 Nov;152(5):447-55. doi: 10.1530/REP-16-0159. Epub 2016 Aug 17. PMID: 27534571.


 Carolin Schliefsteiner
Carolin Schliefsteiner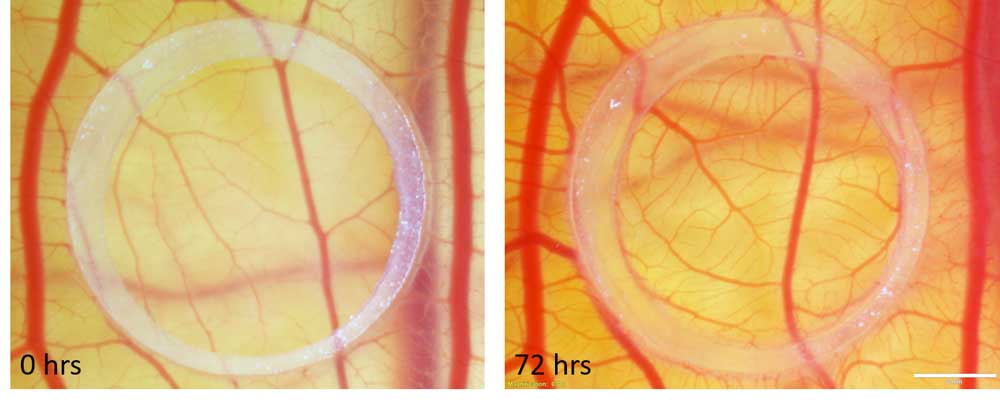
 Monika Horvat Mercnik
Monika Horvat Mercnik Christian Wadsack
Christian Wadsack